oaklanepharmacy.com
6724 Old York Road $5 Generics Program Phone: (215) 924-9929 Fax: (215) 924-4847 last updated April 6, 2009 GENERIC_NAME *PRENATAL VIT W/ FE FUMARATE-FA TAB 27-1 MG***ALBUTEROL SULFATE SOLN NEBU 0.083% (2.5 MG/3ML)ALBUTEROL SULFATE SOLN NEBU 0.5% (5 MG/ML)AMILORIDE & HYDROCHLOROTHIAZIDE TAB 5-50 MGAMITRIPTYLINE HCL TAB 10 MG, 25 MG, 50 MG, 75 MG, 100 MGAMOXICILLIN
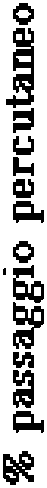 Tabella 1 - Distribuzione percentuale delle regioni anatomiche rispetto alla superficie cutanea.
Tabella 1 - Distribuzione percentuale delle regioni anatomiche rispetto alla superficie cutanea.